En el mundo animal y vegetal, el mimetismo es una estrategia de supervivencia ampliamente descrita por académicos en el área de la ecología, comportamiento animal y biología evolutiva. Las especies miméticas tienen la habilidad de engañar a sus depredadores naturales modificando su apariencia, en cierto modo “imitando” la estética de otra especie con la cual no están relacionados y que no es atractiva para sus depredadores. El mimetismo visual es bien conocido en algunas especies de mariposas [1], que cambian la coloración y el patrón de figuras en sus alas para pasar desapercibidas ante la amenaza de sus depredadores.
Como espectadores, evidenciamos la capacidad mimética por la apariencia del animal u organismo vegetal sin saber que esta es el resultado de numerosas reacciones químicas que, por ejemplo, sintetizan nuevos pigmentos en las alas de mariposas. Aunque invisibles, estos procesos internos son los responsables de que algunas especies de mariposas o peces marinos no sean devoradas [2], y de que algunas plantas con flores atraigan a una mayor cantidad de insectos polinizadores [3]. Como seres humanos no tenemos la herramienta del mimetismo y, por ende, no podemos utilizarla a nuestro favor para mejorar nuestra supervivencia o bienestar. Sin embargo, el ingenio humano y los avances científico-tecnológicos han permitido replicar el concepto del mimetismo para el desarrollo de terapias innovadoras basadas en péptidos, que pueden ser más efectivas que algunas de las estrategias convencionales para el tratamiento de enfermedades.
El momento eureka: insulina y diabetes
El uso de péptidos para el tratamiento de enfermedades humanas se remonta a la década de 1920 cuando, por primera vez, se purificó insulina de páncreas bovino para tratar la diabetes mellitus [4]. La insulina es una hormona secretada en el páncreas, que participa, entre otros procesos metabólicos, en el control de la glucemia. En pacientes diabéticos la producción de insulina se ve alterada y sus niveles de glucosa en la sangre se elevan peligrosamente, por lo que requieren suplementar con insulina exógena para mantener rangos saludables.
Una de las primeras estrategias para obtener insulina para ayudar a pacientes diabéticos fue aislarla desde tejidos de animales no humanos. Actualmente, la insulina que se emplea en el tratamiento de la diabetes mellitus es sintética y se puede producir en grandes cantidades y de manera segura a través de la tecnología de ADN recombinante [5].
La insulina es una de las hormonas sintéticas más demandadas alrededor del mundo producto de la creciente prevalencia de diabetes en la población. Este péptido debe ser administrado por medio de inyecciones ya que, debido a su estructura y naturaleza química, producir comprimidos orales de insulina resulta muy complejo.
La hormona insulina es un péptido formado por 51 aminoácidos, cuya secuencia fue determinada por primera vez por Frederick Sanger en 1951 [6].
Aminoácidos, péptidos y polipéptidos
Los aminoácidos son los elementos fundamentales de las proteínas, que se unen entre sí mediante enlaces covalentes denominados “enlaces peptídicos” para formar péptidos y polipéptidos (Figura 1A). Luego, péptidos y polipéptidos lineales pueden adoptar una conformación tridimensional estableciendo enlaces no covalentes entre los aminoácidos de cadenas no adyacentes (Figura 2B).
La oxitocina, por ejemplo, es una hormona que provoca la contracción de las paredes del útero, y corresponde a un péptido de 9 aminoácidos (nonapéptido) que contiene un ciclohexágono en su estructura, formado a través de puentes disulfuro entre 6 de sus aminoácidos (Figura 2C).

Figura 1.- Aminoácidos, péptidos y polipéptidos. (A) Los aminoácidos son las moléculas elementales de las proteínas, que se unen entre sí a través de enlaces peptídicos para formar cadenas de péptidos y polipéptidos en lo que se entiende como una estructura primaria. De un total de 20 aminoácidos naturales, 9 son catalogados como esenciales ya que el cuerpo humano es incapaz de sintetizarlos y deben ser incorporados mediante la dieta. (B) Los polipéptidos lineales luego adoptan una conformación tridimensional estableciendo enlaces no covalentes entre aminoácidos no adyacentes o de otras cadenas polipetídicas cercanas. Esto se conoce como estructuras de tipo secundarias. La configuración espacial es lo que otorga la función biológica a péptidos, polipéptidos y proteínas, o estructuras terciarias. (C) La hormona oxitocina es un péptido de 9 aminoácidos que contiene un ciclohexágono en su estructura, que se forma por puentes disulfuro entre 6 de sus aminoácidos.
Los seres vivos necesitamos proteínas para vivir, por lo tanto, los aminoácidos que forman estas proteínas son fundamentales. Particularmente, 9 de los 20 aminoácidos que existen son clasificados como esenciales ya que nuestro organismo no los sintetiza y debemos adquirirlos a través de la alimentación. Estos son arginina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, triptófano y valina (Figura 1A).
En relación con la insulina humana, la insulina de animales como vacas y cerdos es similar, pero con pequeñas variaciones que dan cuenta de sus diferencias funcionales. La insulina porcina, por mencionar una, difiere de la insulina humana en 3 aminoácidos dentro de su secuencia lineal [7].
Péptidos como agentes terapéuticos
A partir de la prueba de concepto de F. Banting con insulina en diabetes mellitus, la investigación se concentró en el uso potencial de péptidos endógenos para el tratamiento de enfermedades que, por sus inherentes propiedades medicinales, perfil farmacológico, seguridad y tolerabilidad [8], eran -y siguen siendo- candidatos muy atractivos.
Actualmente, el Catálogo de Péptidos del Proteoma Humano incluye más de 400.000 péptidos obtenidos por digestión con tripsina desde un genoma humano sintético para contribuir a la investigación biomédica [9] y la base de datos THPdb lista cerca de 180 péptidos terapéuticos aprobados por la FDA [10].
Entre las funciones más reconocibles de los péptidos se encuentran su rol como hormonas, neurotransmisores y factores de crecimiento. En general, los péptidos actúan como ligandos de receptores, entonces son moléculas altamente selectivas, específicas y eficaces [8]. En las células que conforman nuestros órganos constantemente se forman nuevos péptidos como productos de la degradación de proteínas, un proceso regular del metabolismo. Así también, los péptidos son rápidamente degradados a aminoácidos.
Los péptidos son generalmente más pequeños que las proteínas, razón por la cual su producción para fines terapéuticos es menos costosa y de menor complejidad, en comparación a la biofarmacia basada en proteínas [8].
Sin embargo, desde un comienzo se presentaron dificultades (Figura 2) ya que los péptidos endógenos son, en general, moléculas inestables, de rápida degradación en el interior de las células en el tracto digestivo, en la sangre, en el hígado y en el riñón. Además, la permeabilidad a través de la membrana celular y la biodisponibilidad oral de péptidos son limitadas [11]. Por lo tanto, cuando son administrados por vía oral, presentan una serie de impedimentos a la entrega efectiva en el tejido donde deben ejercer su efecto. Por esta razón, algunos péptidos con propiedades terapéuticas son administrados por vía intraperitoneal, intravenosa o subcutánea como las inyecciones de insulina.

Figura 2.- Ventajas, desventajas y oportunidades de péptidos terapéuticos.
Con el objetivo de sortear estas desventajas, las y los investigadores recurrieron a diversos métodos para editar péptidos endógenos y así crear análogos con propiedades terapéuticas superiores. Surge así el campo de la terapéutica con peptidomiméticos.
Mimetismo (o imitación) para mejores terapias
Las moléculas biológicamente activas poseen en su estructura una región denominada “farmacóforo”, definida en 1909 por Paul Ehrlich como la “unidad central molecular que transporta los rasgos esenciales responsables para la actividad biológica”. El término ha sido actualizado y actualmente la IUPAC (International Union for Pure and Applied Chemistry, en español Unión Internacional de Química Pura y Aplicada) define farmacóforo como «un conjunto de rasgos estéricos y electrónicos necesarios para asegurar las óptimas interacciones supramoleculares con un blanco biológico específico y desencadenar (o bloquear) su respuesta biológica» [12].
Así, los peptidomiméticos son péptidos cuyo farmacóforo imita el de un péptido o proteína natural y, por lo tanto, tiene la habilidad de interactuar con el mismo objetivo biológico y producir el mismo efecto biológico que su “original” [11].
La edición de la secuencia de aminoácidos de péptidos endógenos o de su disposición tridimensional es específica, controlada y capaz de aumentar o inhibir las interacciones moleculares, de esta manera mejorando su potencial terapéutico. La síntesis de peptidomiméticos a partir de péptidos endógenos se realiza a través de la inducción de modificaciones químicas como isomerización, ciclación o substitución de aminoácidos.
Síntesis de péptidos y peptidomiméticos
En el último siglo se han descrito nuevas enfermedades, lo que ha impulsado el necesario desarrollo de nuevos productos y formas de tratarlas apropiadamente y de manera segura. Con el propósito de ampliar el horizonte de posibilidades y de no depender exclusivamente de péptidos endógenos, nacen las técnicas de síntesis de péptidos.
Los péptidos sintéticos presentaron sus propios desafíos, ya que su rendimiento de producción, nivel de pureza y estabilidad eran bastante bajos. En la década de 1960 convergen dos hitos tecnológicos que contribuyen a superar los obstáculos de la síntesis de péptidos: el primero fue la síntesis de péptidos en fase sólida y el segundo fue la purificación de péptidos por HPLC (High Performance Liquid Chromatography, en español Cromatografía Líquida de Alta Eficacia) [8]. Paralelamente, ocurrió el desarrollo de la rama de la química computacional, las técnicas in-silico y de modelamiento molecular, que permitieron elaborar simulaciones cada vez más precisas de moléculas, interacciones moleculares y sus parámetros fisicoquímicos, aportando a la investigación de péptidos sintéticos y peptidomiméticos para uso terapéutico (Figura 3).

Síntesis de péptidos por diseño racional
Esta aproximación puede comenzar con la obtención de la estructura cristalina del péptido, a partir de las estructuras secundaria y terciaria. Luego se construye la relación estructura-actividad SAR (Structure–Activity Relation) que conduce a la identificación de los aminoácidos elementales y a posibles sitios de sustitución. Para optimizar las propiedades fisicoquímicas del péptido endógeno se introducen modificaciones químicas estratégicas que disminuyen la tendencia a isomerización, glicosilación y oxidación, además de prevenir la formación de agregados y aumentar la solubilidad en agua [8].
Síntesis de peptidomiméticos por sustitución de aminoácidos enantioméricos
La mayoría de los aminoácidos se encuentran en la naturaleza en configuración L (por la convención de levógiro), y es esta configuración en la que nuestro organismo los puede metabolizar a través de la ruptura por hidrólisis de sus enlaces químicos. La configuración D (dextrógiro, por convención) es más frecuente en otras especies de animales y bacterias. Las configuraciones L y D de un mismo aminoácido son isómeros, lo que quiere decir que son moléculas compuestas por los mismos átomos, que tienen la misma fórmula química y comparten muchas propiedades fisicoquímicas, pero su disposición espacial es diferente.
En particular, los enantiómeros son estereoisómeros, vale decir, son pares de moléculas que, dispuestas una frente a la otra, parecen ser la reflexión en un espejo (Figura 4). Las manos humanas son un análogo a gran escala de estereoisomería, y como tal, cuando se superponen no coinciden.
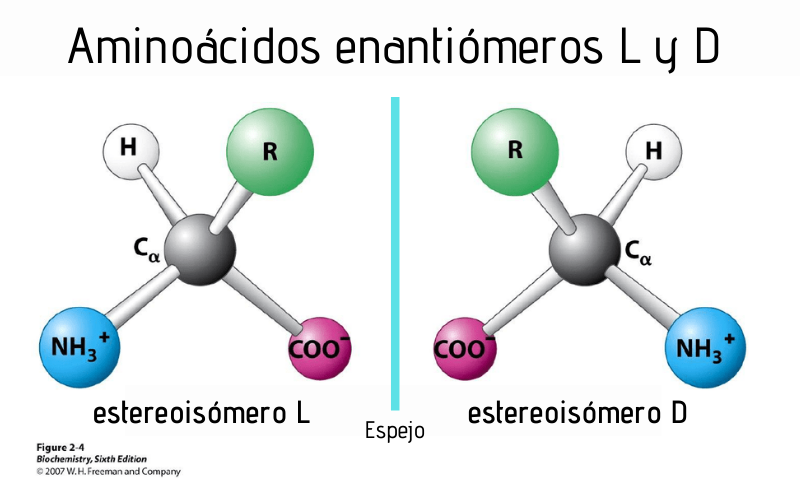
Dado que nuestro organismo no metaboliza D-aminoácidos, cuando estos son incorporados en la síntesis de péptidos biológicamente activos pueden mejorar la estabilidad de la molécula ya que reducen su susceptibilidad a ser degradados.
Síntesis de péptidos y peptidomiméticos por ciclación
Los péptidos cíclicos son cadenas de aminoácidos que forman una estructura cerrada. En comparación con la configuración lineal, la ciclación ofrece ventajas en cuanto a una mayor estabilidad conformacional ya que son más resistentes a ser hidrolizados, y una actividad biológica mejorada [11].
El uso clínico de péptidos cíclicos sintéticos es muy común. Se puede citar el caso del inmunosupresor ciclosporina, un péptido cíclico de 11 aminoácidos utilizado para prevenir el rechazo inmune de órganos en pacientes trasplantados de hígado, riñón o corazón [13].
Los pacientes con diabetes mellitus usualmente deben inyectarse, además de insulina, el fármaco pramlintida, que corresponde a un análogo de la hormona humana amilina, que actúa de forma similar a la insulina luego de una comida. La pramlintida es un péptido cíclico sintético de 37 aminoácidos que difiere de su original amilina por la sustitución de los aminoácidos alanina y serina [11]. Así, la pramlintida es un peptidomimético de la amilina o un amilinomimético.
Diseño de sistemas de entrega alternativos
Una de las desventajas del uso terapéutico de péptidos endógenos es su reducida permeabilidad a través de la membrana celular debido a su naturaleza hidrofílica. Con el objetivo de mejorar la permeabilidad transmembrana y, simultáneamente, extender la vida media de péptidos endógenos, se puede recurrir a la síntesis de conjugados con ácidos grasos, que son moléculas hidrofóbicas. De esta manera, los péptidos quedan “protegidos” frente a la degradación y pueden atravesar la membrana celular sin mayor dificultad [11].
Aún más, estos conjugados pueden ser luego encapsulados dentro de microesferas formadas por biopolímeros para optimizar su efecto terapéutico, ya que de esta forma la liberación de los péptidos biológicamente activos es más lenta [14]. En sistemas de entrega lenta, el efecto biológico del agente terapéutico, en este caso los péptidos, es más duradero, por ende los pacientes pueden reducir la frecuencia de administración.
Comúnmente, los péptidos con propiedades terapéuticas deben ser administrados en formato inyectable, como la insulina, lo que supone diversas complicaciones para los pacientes, que obstaculizan la efectividad y adherencia a los tratamientos. Es por esta razón que una porción importante de la investigación sobre péptidos terapéuticos está enfocada en el desarrollo de nuevos sistemas de entrega, incluyendo la administración oral, bucal, sublingual, nasal, transdermal y tópica, por mencionar algunas.
El futuro de los peptidomiméticos
Los peptidomiméticos no son un caso aislado en que fenómenos de la naturaleza, como el mimetismo, sirven de inspiración para el desarrollo de tecnologías para aplicaciones biomédicas. La famosa técnica de edición genética CRISPR-Cas9, por la cual las investigadoras Emmanuelle Charpentier y Jennifer A. Doudna recibieron el Premio Nobel de Química 2020, está basada en el sistema de defensa natural de especies bacterianas ante el ataque de virus [15].
Las futuras aplicaciones que se proyectan para CRISPR incluyen desde su uso en agricultura hasta el desarrollo de terapias que podrían ayudar al tratamiento del cáncer o curar enfermedades genéticas como la distrofia muscular. Las proyecciones para el ámbito de los peptidomiméticos son más modestas, pero no por eso menos emocionantes. Los expertos prevén que las estrategias de diseño de péptidos y peptidomiméticos podrían aplicarse en el tratamiento de diversas patologías, como algunos tipos de cáncer, la enfermedad de Alzheimer, enfermedades metabólicas e infecciones microbianas [16].
Actualmente, el diseño de péptidos y peptidomiméticos terapéuticos a través de métodos computacionales se traduce en cerca de 20 nuevos ensayos clínicos cada año [17]. Con la implementación de estrategias que combinen metodologías teóricas y experimentales, los productos de la investigación científica y desarrollo tecnológico innovador de peptidomiméticos podrían convertirse en la próxima generación de terapias humanas más eficientes.
Referencias:
[1] Iijima, T., Yoda, S. & Fujiwara, H. The mimetic wing pattern of Papilio polytes butterflies is regulated by a doublesex-orchestrated gene network. Communications Biology 2, 257 (2019). Disponible para descarga gratuita.
[2] Moland, E., Eagle, J. & Jones, G. Ecology and Evolution of Mimicry in Coral Reef Fishes. Oceanography and marine biology 43: 455-482 (2005). Disponible para descarga gratuita.
[3] Goodrich, K. & Jürgens, A. Pollination systems involving floral mimicry of fruit: aspects of their ecology and evolution. New Phytologist 217, 1: 74-81 (2018). Disponible para descarga gratuita.
[4] Banting, FG., et al. Pancreatic extracts in the treatment of diabetes mellitus. Canadian Medical Association Journal 12: 141–146 (1922). Disponible para descarga gratuita.
[5] Johnson, IS. Human insulin from recombinant DNA technology. Science 219, 4585: 632-637 (1983). DOI: 10.1126/science.6337396
[6] Sanger, F., & Tuppy, H. The amino-acid sequence in the phenylalanyl chain of insulin. 1. The identification of lower peptides from partial hydrolysates. Biochemical Journal 49: 463–481 (1951). Disponible para descarga gratuita.
[7] Knip, M., et al. Environmental Triggers and Determinants of Type 1 Diabetes. Diabetes 54(suppl 2): S125-S136 (2005). Disponible para descarga gratuita.
[8] Fosgerau, K., & Hoffmann, T. Peptide therapeutics: current status and future directions. Drug Discovery Today 20: 122-128 (2015). Disponible para descarga gratuita.
[9] Zolg, D., et al. Building ProteomeTools based on a complete synthetic human proteome. Nature Methods 14: 259–262 (2017). DOI: 10.1038/nmeth.4153
[10] Usmani SS, Bedi G, Samuel JS, Singh S, Kalra S, Kumar P, et al. THPdb: Database of FDA-approved peptide and protein therapeutics. PLoS ONE 12(7): e0181748 (2017). Disponible para descarga gratuita.
[11] Qvit N., Rubin, S., Urban, T., Mochly-Rosen D., Gross E. Peptidomimetic therapeutics: scientific approaches and opportunities. Drug Discovery Today 22, 2: 454-462 (2017). Disponible para descarga gratuita.
[12] Wermuth CG, Ganellin CR, Lindberg P. & Mitscher LA. Glossary of terms used in medicinal chemistry (IUPAC Recommendations 1998). Pure Applied Chemistry 70, 5: 1129-1143 (1998). Disponible para descarga gratuita.
[13] Survase SA, et al. Cyclosporin A: a review on fermentative production, downstream processing and pharmacological applications. Biotechnology Advances 29:418–435 (2011). DOI: 10.1016/j.biotechadv.2011.03.004
[14] Kim D, et al. Effects of once-weekly dosing of a long-acting release formulation of exenatide on glucose control and body weight in subjects with type 2 diabetes. Care Diabetes 30: 1487–1493 (2017). Disponible para descarga gratuita
[15] Rouet, R. et al. Receptor-Mediated Delivery of CRISPR-Cas9 Endonuclease for Cell-Type-Specific Gene Editing. Journal of the American Chemical Society 140, 21: 6596–6603 (2018). DOI: 10.1021/jacs.8b01551
[16] Mabonga, L., & Kappo, A. P. Peptidomimetics: a synthetic tool for inhibiting Protein–Protein interactions in cancer. International Journal of Peptide Research and Therapeutics 26: 225–241 (2019). Disponible para descarga gratuita.
[17] D’Annessa I., et al. Bioinformatics and Biosimulations as Toolbox for Peptides and Peptidomimetics Design: Where Are We?. Frontiers Molecular Biosciences 7, 66 (2020). Disponible para descarga gratuita.


0 comentarios