Desde que se identifica que una sustancia química o molécula, que puede ser obtenida de la naturaleza o fabricada por el ser humano (sintética), tiene potencial terapéutico y que podría ser utilizada para el alivio de síntomas o el tratamiento de enfermedades, hasta que se aprueba su uso como medicamento y podemos obtenerlo en farmacias, transcurren numerosas etapas y varios años de pruebas.
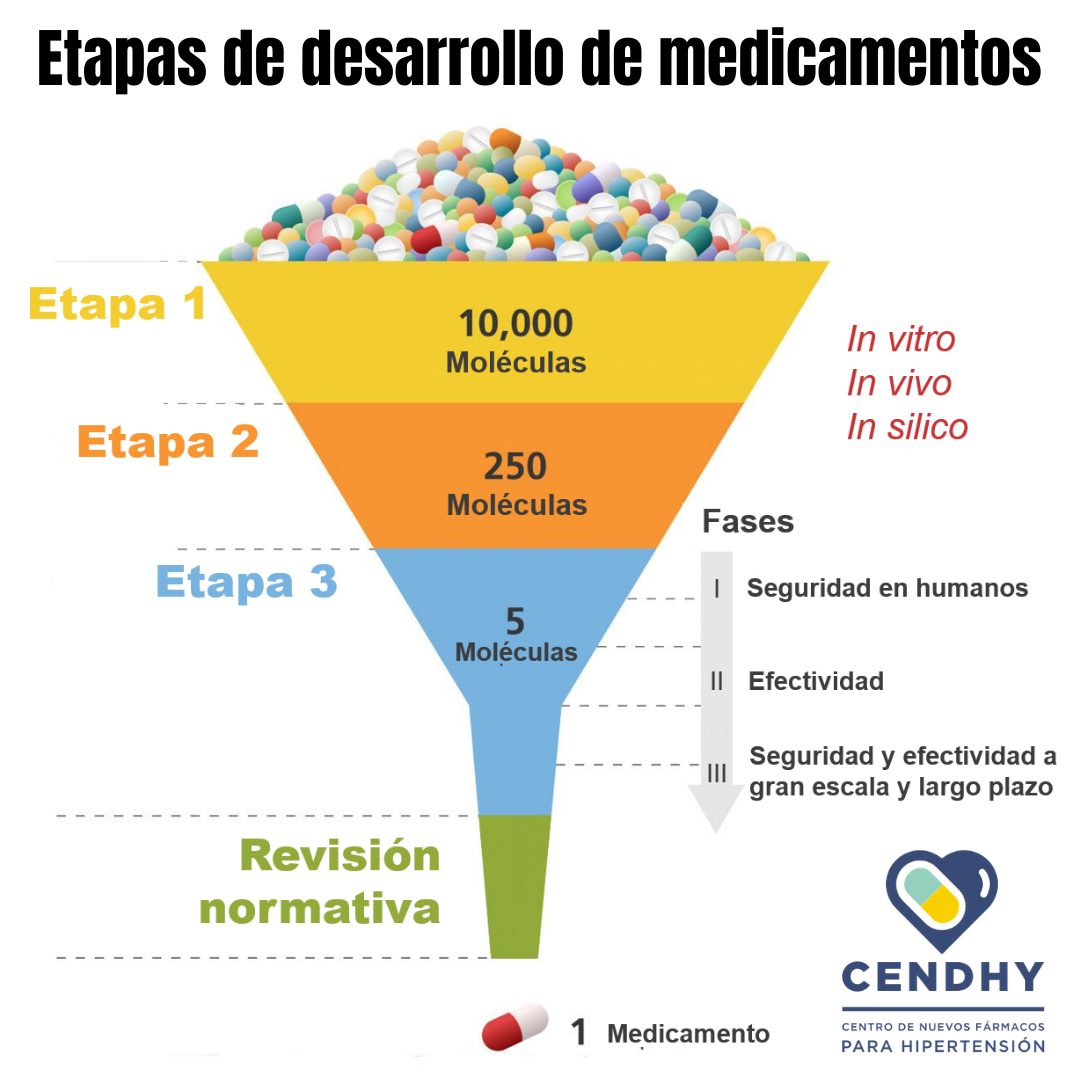
El desarrollo de un medicamento comienza en la etapa de «descubrimiento de fármacos», en donde se identifica un compuesto químico que tiene características que podrían ser útiles en el tratamiento de una enfermedad o alivio de síntomas.

Posteriormente, en la etapa de desarrollo preclínico, se estudia si las moléculas realmente poseen efectos terapéuticos, al mismo tiempo que se corrobora que sea inocuo para la salud y que los efectos adversos sean mínimos.

Se definen también la forma farmacéutica, el sistema de entrega, la biodisponibilidad y farmacocinética (revisa la entrada «Tipos de medicamentos» para recordar estos conceptos).

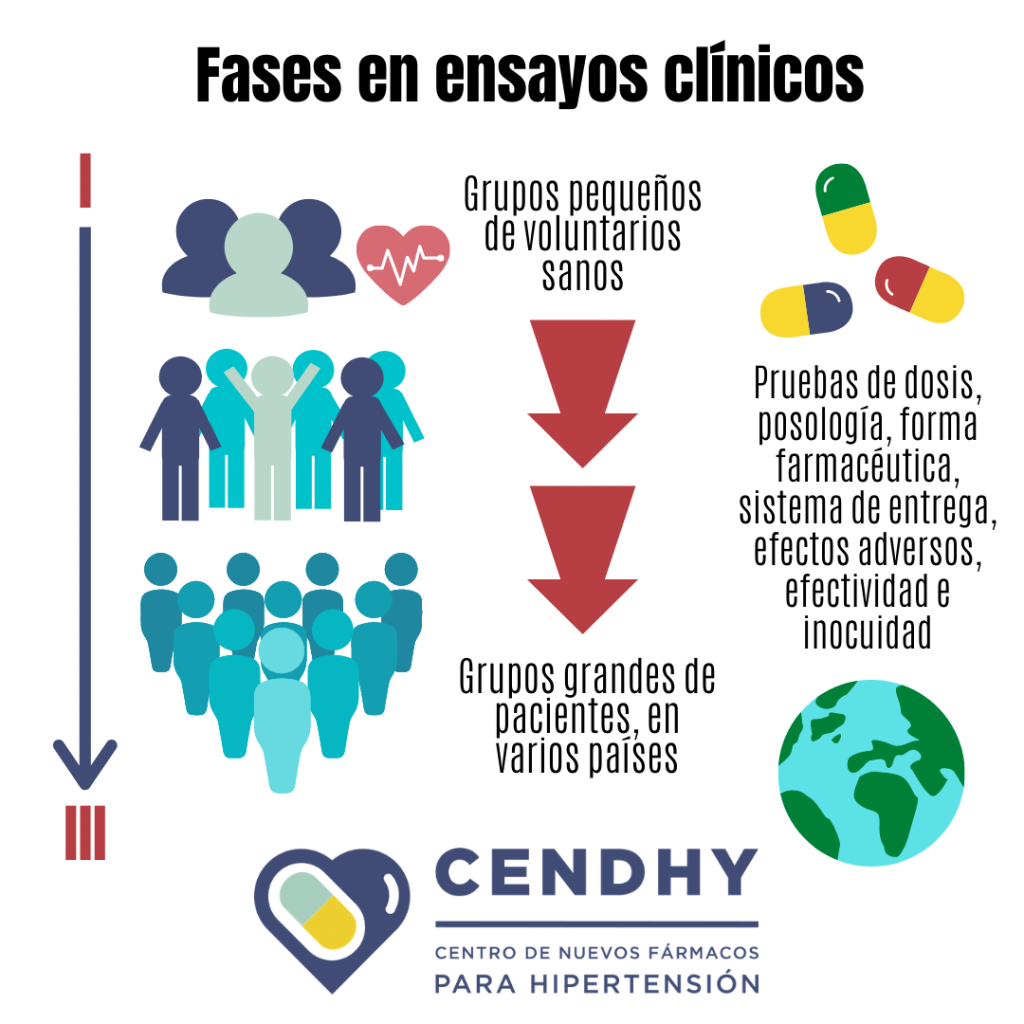
En la tercera etapa se realizan los ensayos clínicos, que requieren el reclutamiento de voluntarios para examinar el efecto de las moléculas en humanos. ¿Has escuchado de los ensayos de la vacuna para coronavirus en Chile? Esto es porque los ensayos clínicos deben realizarse en varios países para comprobar la efectividad e inocuidad, así como se hace con los fármacos antes de que sean aprobados.

Los ensayos preclínicos y clínicos se pueden clasificar en: in vitro, in vivo e in silico. Un ensayo in vitro se realiza en el laboratorio dentro de una placa de petri, tubo de ensayo o similar. Los ensayos in vivo se realizan en el organismo de plantas o animales. Lo opuesto a in vivo (dentro) es ex vivo, que son ensayos que se realizan fuera de un organismo, por ejemplo en tejidos u órganos aislados. Por último, los ensayos in silico son simulaciones y modelamientos que se realizan en ordenadores o computadores (estamos preparando una entrada sobre esto con nuestro investigador postdoctoral Dr. Osvaldo Yáñez).
La etapa final corresponde a la evaluación y aprobación normativa, en donde se revisan aspectos regulatorios por organismos como la FDA (Food & Drugs Administration). El producto aprobado luego debe ser producido y comercializado por una empresa farmacéutica.

Hasta ahora nos hemos referido al desarrollo de medicamentos «desde cero», pero existe otra estrategia que permite «reutilizar» fármacos para otros propósitos cuando es necesario. La revisamos a continuación.
Reposicionamiento de fármacos
Frente a la urgencia por surgir rápidamente con un tratamiento para COVID19, ya sea preventivo como una vacuna o paliativo como un medicamento, varios fármacos que ya existen en el mercado están siendo probados para ser reutilizados para combatir el coronavirus.
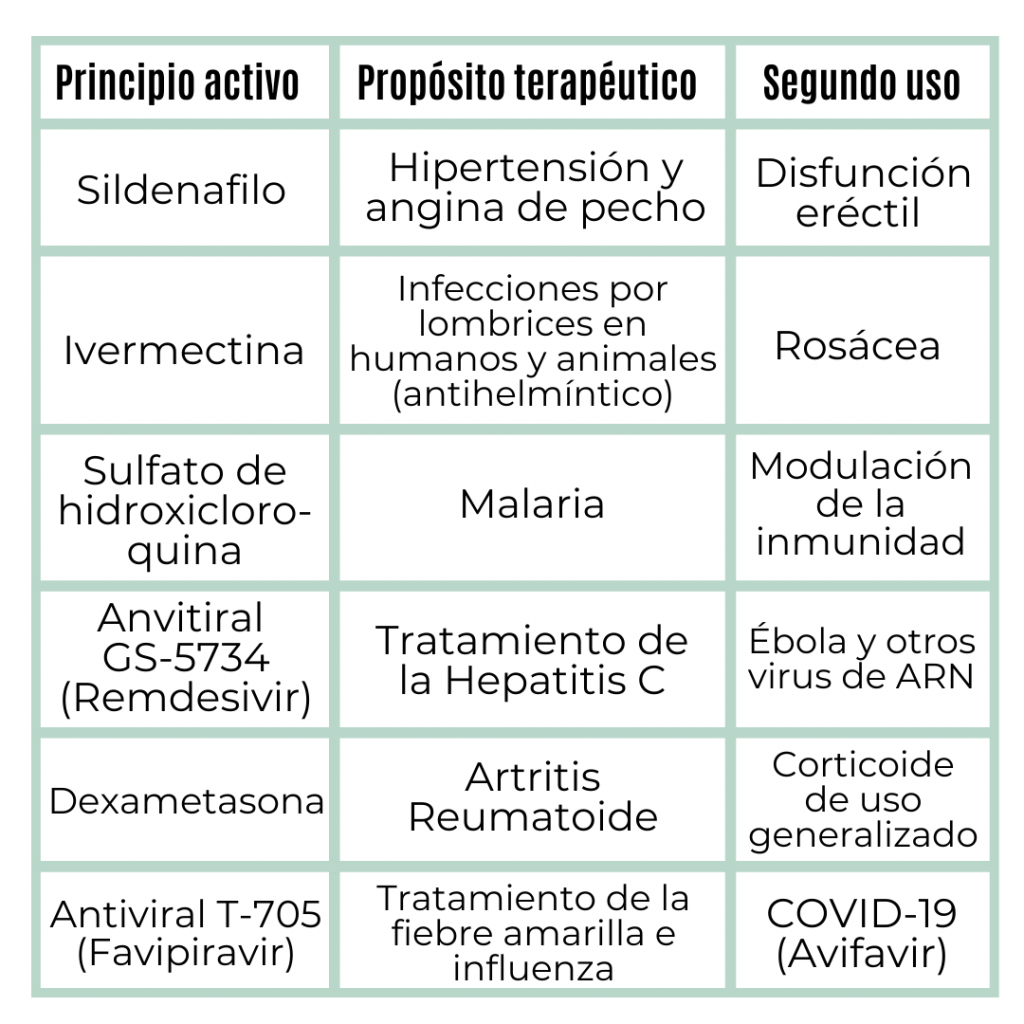
El reposicionamiento de fármacos consiste en reutilizar un medicamento que actualmente se utiliza para un cierto cuadro clínico, estudiar cómo se comporta frente a otra enfermedad, ponerlo a prueba y llevarlo al mercado con este segundo uso terapéutico. El caso emblemático es el Viagra o sildenafilo.

Hoy ante la necesidad que suscita la pandemia, científicos alrededor del mundo están probando con fármacos como la ivermectina, la hidroxicloroquina, el remdesivir, la dexametasona y el avifavir, entre otros. Como estos fármacos ya pasaron por la etapa de descubrimiento, ahora «solo» basta con superar las etapas de ensayos preclínicos y clínicos, y la revisión normativa.
En las siguientes tablas, actualizadas hasta el 6 de julio, puedes ver para qué uso fueron desarrollados estos fármacos originalmente y para qué patología fueron reposicionados. Luego, en qué etapa se encontraban en su reposicionamiento para COVID-19.
Esta entrada fue elaborada en colaboración con la estudiante de Bioquímica, Victoria Aguayo, investigadora en el Drug Delivery Lab del Dr. Javier Morales Montecinos. Puedes encontrarla en nuestro instagram y en el canal de Youtube de CENDHY. ¡Comparte si te gustó!
Referencias:
*Repositorio Internacional de la OPS (IRIS/OMS).
*Ensayos clínicos inscritos en el NIH clinicaltrials.gov
*Resultados de ensayos clínicos de la Universidad de Oxford recoverytrials.net/results
*Cali L, et al (2020). The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Research 178, 104787.
*COVID-19 Treatment and Vaccine Tracker, Milken Institute.







0 comentarios